Cục Quản lý Dược vừa yêu cầu Công ty cổ phần dược phẩm Cửu Long khẩn trương thu hồi toàn bộ lô thuốc viên nén Alfachim 4.2 (Chymotrypsin 4200 IU), số lô 03010624, do không đạt tiêu chuẩn chất lượng. Loại thuốc này được chỉ định để chống phù nề và kháng viêm, thường dùng trong điều trị các trường hợp phù nề sau chấn thương, bỏng hoặc phẫu thuật.
Quyết định được đưa ra sau khi Viện Kiểm nghiệm thuốc Trung ương phát hiện lô thuốc này không đạt tiêu chuẩn chất lượng trong một đợt kiểm nghiệm hồi tháng 5. Ngay sau đó, Cục Quản lý Dược đã yêu cầu thu hồi lô thuốc trên địa bàn Hà Nội, đồng thời yêu cầu công ty Cửu Long lấy mẫu bổ sung để kiểm tra lại.
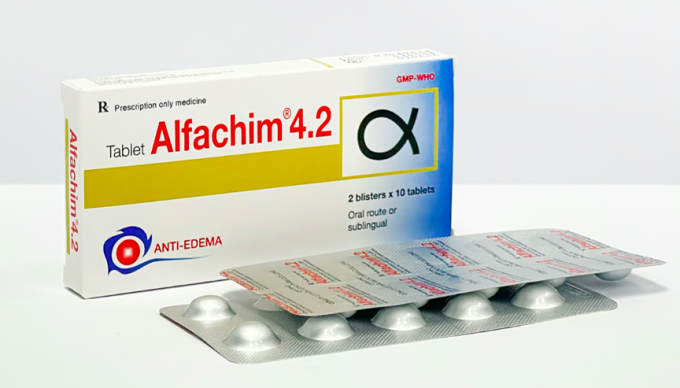
Tuy nhiên, quá thời hạn 15 ngày, công ty Cửu Long không báo cáo kết quả kiểm tra chất lượng mẫu bổ sung mà chỉ báo cáo về tình hình sản xuất, phân phối và thu hồi thuốc. Sau đó, công ty đã chủ động đề nghị được tự nguyện thu hồi lô thuốc này. Do đó, ngày 22/6, Cục Quản lý Dược đã chính thức yêu cầu công ty phối hợp với các nhà phân phối để thu hồi toàn bộ lô thuốc không đạt chuẩn.
Cục Quản lý Dược cũng yêu cầu Sở Y tế Hà Nội và Vĩnh Long tăng cường kiểm tra, giám sát việc thu hồi và xử lý lô thuốc này của công ty Cửu Long, đồng thời đánh giá nguy cơ thuốc có thể tiếp tục lưu hành và ảnh hưởng đến sức khỏe người tiêu dùng.
Ông Tạ Mạnh Hùng, Phó Cục trưởng Cục Quản lý Dược, cho biết cơ quan này đã phát hiện nhiều sai phạm tại các cơ sở sản xuất, kinh doanh dược phẩm, thu hồi và tiêu hủy nhiều thuốc, mỹ phẩm giả, kém chất lượng trong tháng cao điểm chống buôn lậu, gian lận thương mại và hàng giả. Nhiều loại thuốc giả, không rõ nguồn gốc như thuốc dạ dày, cúm, hen phế quản, tiểu đường đã bị phát hiện tại các nhà thuốc.
Ông Hùng nhấn mạnh tình trạng hàng giả, hàng không rõ nguồn gốc xuất xứ chủ yếu tập trung vào nhóm thực phẩm chức năng, thực phẩm bảo vệ sức khỏe, thuốc đông y và mỹ phẩm. Trong tháng vừa qua, cơ quan chức năng đã kiểm tra đột xuất 38 cơ sở và phát hiện 17 cơ sở vi phạm. Tại 20 tỉnh, thành phố, các đoàn kiểm tra đã kiểm tra 865 cơ sở sản xuất, nhập khẩu và kinh doanh thuốc, mỹ phẩm, phát hiện 48 cơ sở vi phạm.
Trước tình hình này, Bộ Y tế đang xây dựng kế hoạch triển khai đồng bộ các giải pháp, bao gồm rà soát các quy định pháp luật để tăng cường chế tài xử lý, nâng cao hiệu quả kiểm tra, giám sát, xây dựng cơ sở dữ liệu thuốc được cấp phép lưu hành và kết nối liên thông các cơ sở kinh doanh dược để truy xuất nguồn gốc thuốc, đồng thời đẩy mạnh công tác hậu kiểm, thanh tra định kỳ và đột xuất.
Admin
Nguồn: VnExpress